PhysProf - Isochore Zustandsänderung - Hauptsätze - Enthalpie

Fachthemen: Isochore Zustandsänderung
Hauptsätze der Thermodynamik - Volumenänderungsarbeit - Volumenarbeit - Innere Energie - Enthalpie - Wärmeinhalt - Gesetz von Amontons - Gesetz von Gay-Lussac
PhysProf - Thermodynamik - Wärmelehre - Ein Programm zur Visualisierung physikalischer Sachverhalte aus der Naturwissenschaft mittels Simulationen und 2D-Animationen für die Schule, das Abitur, das Studium sowie für Lehrer, Ingenieure und alle die sich für Physik interessieren.
Online-Hilfe für das Modul
zur grafischen Darstellung und Untersuchung des Prozessablaufs bei isochoren Zustandsänderungen.
Dieses Unterprogramm ermöglicht die Durchführung der Steuerung entsprechender Abläufe zur Echtzeit und bietet die Möglichkeit, die Einflüsse relevanter Größen interaktiv zu untersuchen.
Es eignet sich zudem als ergänzendes Unterrichtsmaterial zum Physikunterricht und Abitur, unterstützt dabei ein tiefergehendes Verständnis zu diesem Themengebiet zu erlangen und kann zum Lösen vieler diesbezüglich relevanter Aufgaben eingesetzt werden.

Weitere relevante Seiten zu diesem Programm

Themen und Stichworte zu diesem Modul:Isochorer Prozess - Isochore Zustandsänderung - pT-Diagramm - Isochor - Volumen - Druck - Temperatur - Zustandsänderung - Innere Energie - Gasmasse - Wärmeenergie - Thermische Energie - Isochore Erwärmung - pV-Diagramm - pV Diagramm - pT Diagramm - Energiediagramm - Gesetz von Amontons - 2. Gesetz von Gay-Lussac - Zustandsgrößen - Zustandsgröße - Thermodynamische Zustandsgröße - Arbeit - Druck-Temperatur-Diagramm - Thermisch - Thermodynamisch - Zustandsänderungen - Wärme - Diagramm - Energie - Einheit - Herleitung - Beweis - Physikalische Einheit - Gas - Temperaturdifferenz - Hauptsatz - Hauptsätze - Nullter Hauptsatz - Nullter Hauptsatz der Thermodynamik - Erster Hauptsatz der Thermodynamik - Erster Hauptsatz der Wärmelehre - 1. Hauptsatz der Thermodynamik - 1. Hauptsatz der Wärmelehre - Zweiter Hauptsatz der Thermodynamik - Zweiter Hauptsatz der Wärmelehre - 2. Hauptsatz der Thermodynamik - 2. Hauptsatz der Wärmelehre - Entropiesatz der Thermodynamik - 3. Hauptsatz der Thermodynamik - 3. Hauptsatz der Wärmelehre - Entropieänderung - Enthalpie - Enthalpien - Wärmeinhalt - Grundlagen - Molare Enthalpie - Spezifische Enthalpie - Reaktionsenthalpie - Reaktionswärme - Volumenänderungsarbeit - Volumenarbeit - Zugeführte Energie - Abgegebene Energie - Freie Enthalpie - Freie Reaktionsenthalpie - Gibbs-Energie - Verändern - Veränderung - Ändern - Änderung - Begriff - Begriffe - Definition - Was - Wie - Weshalb - Was ist - Warum - Bedeutung - Was bedeutet - Erklärung - Einfach erklärt - Einführung - Beschreibung - Arbeitsblatt - Arbeitsblätter - Unterrichtsmaterial - Unterrichtsmaterialien - Lernen - Aufgaben - Abituraufgaben - Abiturvorbereitung - Abitur - Abi - Leistungskurs - LK - Klassenarbeit - Klassenarbeiten - Anwendungsaufgaben - Physik - Physikalisch - Unterricht - Zusammenhang - Material - Thermodynamik - Grundlagen - Grundlegendes - Abitur - Rechner - Beispiel - Animation - Bild - Berechnen - Simulation - Berechnung - Formeln - Formelzeichen - Berechnungsformel - Vorgang - Vorgänge - Gleichung - Prozess - Darstellen - Grafik - Grafische Darstellung |
 |  |
Isochore Zustandsänderung - Hauptsätze der Thermodynamik
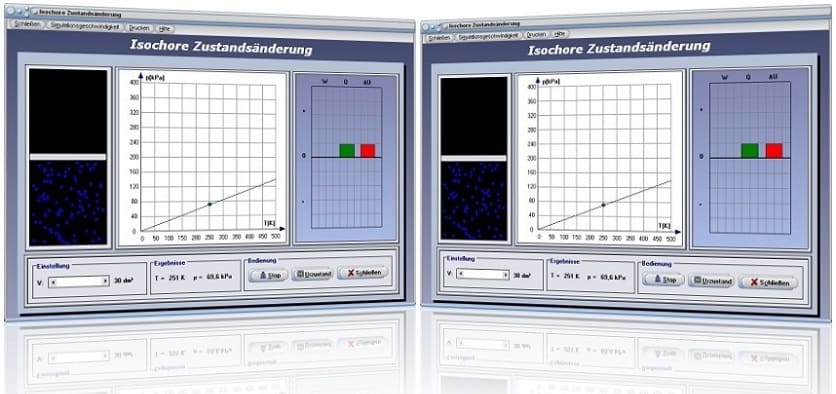
Modul Isochore Zustandsänderung
Das Unterprogramm [Thermodynamik] - [Isochore Zustandsänderung] demonstriert den Prozessablauf einer isochoren Zustandsänderung bei einem realen Gas.

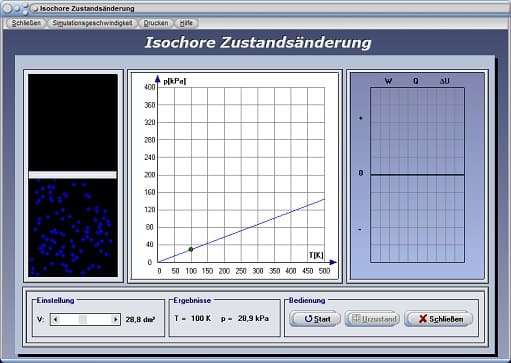
Isochore Zustandsänderung - Abbildung 1

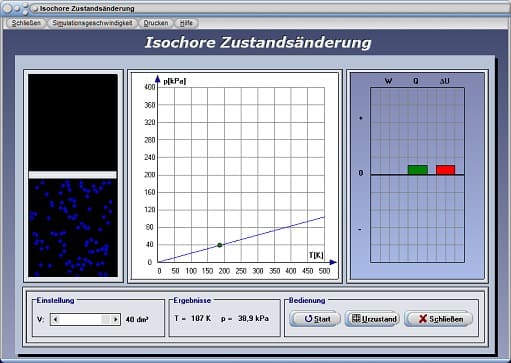
Isochore Zustandsänderung - Abbildung 2
Unter Wärmeenergie (thermische Energie) wird diejenige Energie verstanden, die Teil der inneren Energie eines Systems ist, die in der ungeordneten Bewegung der Atome und Moleküle dieses Systems vorhanden ist.
Als Zustandsänderung wird die Veränderung des Zustands eines Stoffes durch thermodynamische Prozesse bezeichnet. Zustandsänderungen können reversibel oder irreversibel erfolgen.
Isochor: Die isochore Zustandsänderung (ein isochorer Prozess) beschreibt eine Zustandsänderung eines Gases, bei welcher das Volumen dessen konstant bleibt.
Als Zustandsgrößen werden Größen bezeichnet, die den momentanen Zustand eines Systems beschreiben. Dessen Zustandekommen wird hierdurch nicht übermittelt. Nach der Zustandsgleichung eines idealen Gases wird bei einer isochoren Zustandsänderung keine Arbeit verrichtet (es erfolgt keine Volumenänderung). Nach dem ersten Hauptsatz der Thermodynamik (siehe unten) geht eine zugeführte Energie direkt in die innere Energie U über.
Als Bedingung für eine isochore Zustandsänderrung gilt:

Es bestehen folgende Beziehungen zwischen Druck und Temperatur:


Für die Wärmeenergie gilt (Grundgleichung der Wärmelehre):

Für die verrichtete Arbeit gilt:

Für die Änderung der inneren Energie gilt:

Hierbei sind:
p1: Druck im Anfangszustand [Pa]
p2: Druck im Endzustand [Pa]
T1: Temperatur im Anfangszustand [K]
T2: Temperatur im Endzustand [K]
ΔV: Volumenänderung [m³]
ΔT: Temperaturänderung [K]
W: Verrichtete Arbeit [J]
Q: Wärmeenergie [J]
cv: Spezifische Wärmekapazität bei konstantem Volumen [J/(kgK)]
ΔU: Änderung der inneren Energie [J]
m: Gasmasse [kg]
Die folgende Grafik stellt das pv-Diagramm einer isochoren Zustandsänderung dar.
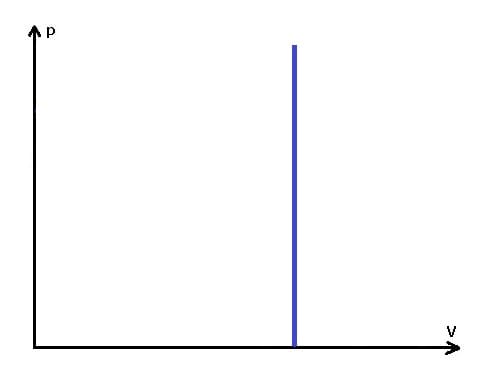
Programmbedienung
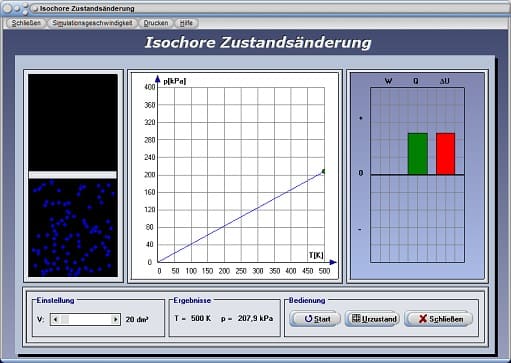
Mit Hilfe des Schiebereglers V kann das Volumen V eingestellt werden. Nach einer Bedienung der Schaltfläche Start wird das pT-Diagramm (Druck-Temperatur-Diagramm) für einen isochoren Prozess gezeichnet. Am dargestellten Energiediagramm werden die Änderung der inneren Energie ΔU, die dem System zugeführte Wärmeenergie Q und die am System verrichtete Arbeit W ausgegeben. Beachten Sie hierbei, dass die bei einem isochoren Prozess verrichtete Arbeit gleich null ist und die gesamte Wärme aufgewendet wird um die innere Energie des Gases zu ändern.
Übersicht - Formeln
Die nachfolgende Tabelle zeigt Formeln, die bei einer isochoren Zustandsänderung Gültigkeit haben.
| Bedingung | ΔV = 0 dV = 0 |
| 1. Hauptsatz | Q = ΔU dQ = dU |
| Druck, Volumen, Temperatur p,V,T | 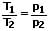 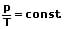 |
| Wärmeenergie | Q = cvm ΔT dQ = cvm dT |
| Arbeit | W = 0 dw = 0 |
| Entropieänderung | ΔS = cvm ln(p2/p1) ΔS = cvm ln(T2/T1) 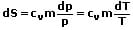 |
| Änderung innerer Energie | ΔU = cvm ΔT dU = cvm dT |
Die Entropieänderung beschreibt die Änderung der Entropie ΔS während einer Zustandsänderung.
Gesetz von Amontons - 2. Gesetz von Gay-Lussac - Zustandsgrößen
Als Zustandsgröße wird eine physikalische Größe bezeichnet, die den momentanen Zustand eines Systems beschreibt. Zu diesen zählen in der Thermodynamik unter anderem Größen wie das Volumen, die innere Energie oder die Entropie.
Das Gesetz von Amontons (2. Gesetz von Gay-Lussac) besagt, dass der Druck einer gegebenen Gasmasse bei gleichbleibendem Volumen direkt proportional zur Temperatur ist. Es gilt:
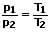
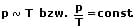
p1: Druck im Anfangszustand [Pa]
p2: Druck im Endzustand [Pa]
T1: Temperatur im Anfangszustand [K]
T2: Temperatur im Endzustand [K]
Hauptsätze der Thermodynamik - Hauptsätze der Wärmelehre
Nachfolgend sind die Hauptsätze der Thermodynamik (Hauptsätze der Wärmelehre) aufgeführt.
Nullter Hauptsatz (0. Hauptsatz) der Wärmelehre:
Der nullte Hauptsatz der Thermodynamik (nullte Hauptsatz der Wärmelehre) besagt, dass zwei in Kontakt stehende Systeme genau dann die gleiche Temperatur besitzen, wenn sie sich im thermischen Gleichgewicht befinden.
Erster Hauptsatz (1. Hauptsatz) der Wärmelehre:
Der erste Hauptsatz der Thermodynamik (erster Hauptsatz der Wärmelehre) lautet: Die Änderung der inneren Energie eines geschlossenen Systems ist gleich der Summe der Änderung der Wärmeenergie und der Änderung der mechanischen Energie (Arbeit). Dies besagt, dass die gesamte Energie in einem abgeschlossenen System konstant ist. Es gilt:
ΔU = ΔQ + ΔW
bzw.
dU = dQ + dW
ΔQ: Wärmeenergie, die dem System zugeführt wird
ΔW: vom System verrichtete Arbeit
ΔU: Änderung der inneren Energie
Zugeführte Wärmeenergie und die am System verrichtete Arbeit sind positiv und die am System verrichtete Arbeit ist hingegen negativ.
Zweiter Hauptsatz (2. Hauptsatz - Entropiesatz der Thermodynamik):
Der zweite Hauptsatz der Wärmelehre (zweiter Hauptsatz der Thermodynamik) beschreibt, in welcher Richtung Energieumwandlungen möglich sind. Er besagt, dass Wärme nur unter Aufwand mechanischer Arbeit von einem Körper niedriger Temperatur auf einen Körper höherer Temperatur übergehen kann.
Die Umwandlung von Wärme in mechanische Energie geschieht nur teilweise, da die Umwandlung von Wärmeenergie in mechanische Energie stets mit Verlusten behaftet ist. Es handelt sich hierbei um einen irreversiblen Prozess. Bei einem technischen Prozess, bei welchem Wärmeenergie in mechanische Arbeit umgewandelt wird ist der Wirkungsgrad stets geringer als 100 %. Es gilt:
η < (T2-T1)/T1
η: Wirkungsgrad
T1: Temperatur im Anfangszustand
T2: Temperatur im Endzustand
Der Wissenschaflter Sir Kelvin (1824 - 1907) machte die hierzu Aussage:
"Es ist unmöglich, eine zyklisch arbeitende Maschine zu konstruieren, die keinen anderen Effekt hat, als die Entnahme von Wärme aus einem Behälter und die Verrichtung eines gleichen Betrages an Arbeit."
Der Physiker Rudolf Clausius (1822 - 1871) formulierte hierzu:
"Die Energie des Universums ist konstant, die Entropie des Universums strebt immer einem Maximum zu, der 1. Hauptsatz ist Energieerhaltungssatz und deshalb ein Symmetriegesetz. Der 2. ist kein Symmetriegesetz und er drückt ein Prinzip aus, das die Symmetrie des Weltalls sprengt, indem es eine bestimmte Richtung seiner Veränderung fordert."
Dritter Hauptsatz (3. Hauptsatz):
Der dritte Hauptsatz der Thermodynamik besagt, dass es nicht möglich ist, ein System bis auf den absoluten Nullpunkt 0 K (-273,15 °C) abzukühlen.
Dieser Satz wurde vom deutschen Physiker Walther Nernst (1864 - 1941) im Jahr 1906 verfasst und besagt die Unerreichbarkeit des Nullpunktes der absoluten Temperatur.
Volumenänderungsarbeit - Volumenarbeit
Als Volumenänderungsarbeit (Volumenarbeit) wird die an einem abgeschlossenen System zu verrichtende Arbeit bezeichnet, die erforderlich ist, um die Kompression oder Expansion des darin enthaltenen Gases zu verursachen. Bleibt der Druck des Gases konstant, so gilt:
W = -pΔV
W: Volumenänderungsarbeit [J]
p: Druck des Gases [Pa]
ΔV: Volumenänderung des Gases [m³]
Wenn sich der Druck während der Volumenänderung ändert, so gilt:
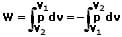
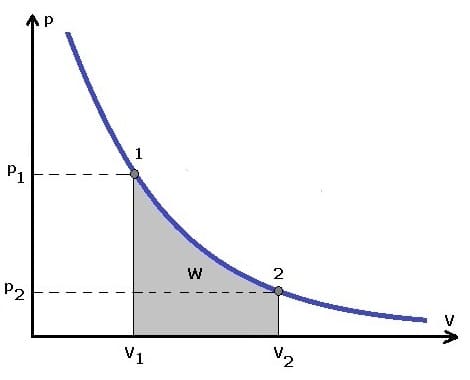
Innere Energie
Als innere Energie U wird die gesamte für thermodynamische Umwandlungsprozesse zur Verfügung stehende Energie eines physikalischen Systems bzezeichnet, das sich im Ruhezustand und im thermodynamischen Gleichgewicht befindet. Für die innere Energie eines Gases gilt:
U = cvmT
Die innere Energie eines Gases mit einer bestimmten Masse hängt lediglich von seiner Temperatur ab.
Enthalpie - Wärmeinhalt - Freie Enthalpie - Reaktionsenthalpie - Gibbs-Energie
Die Enthalpie (oder der Wärmeinhalt) eines thermodynamischen Systems ist eine thermodynamische Zustandsgröße. Sie ist die Summe aus innerer Energie und dem Produkt aus Druck und Volumen und wird in Joule angegeben. Ihre Definition lautet:
H = U + pV
H: Enthalpie [J]
U: Innere Energie [J]
p: Druck [Pa]
V: Volumen [m³]
Als molare Enthalpie wird die auf eine Stoffmenge n bezogene Enthalpie bezeichnet. Es gilt:
Hm = H/n
Hm: Molare Enthalpie [J/mol]
H: Enthalpie [J]
n: Stoffmenge [mol]
Unter der spezifischen Enthalpie wird die auf die Masse m bezogene Enthalpie verstanden. Es gilt:
h = H/m
h: Spezifische Enthalpie [J/kg]
H: Enthalpie [J]
m: Masse [kg]
Die Reaktionsenthalpie ΔH (Reaktionswärme) ist eine Kenngröße für die beim Ablauf einer Reaktion abgegebene bzw. aufgenommene Wärmemenge. Sie kann nicht direkt messtechnisch erfasst werden, sondern bildet sich aus der Differenz der erfassten Wärmemenge zweier Zustände. Für sie gilt:
ΔH = HEndzustand - HAnfangszustand
Die freie Enthalpie (Gibbs-Energie, benannt nach Josiah Willard Gibbs) ist ein Maß für die Triebkraft eines Prozesses (einer Reaktion) und wird mit dem Buchstabe G abgekürzt und in Joule angegeben. Sie gibt denjenigen Teil der Energie an, von dem bei einer ablaufenden Reaktion bei konstanter Temperatur und konstantem Druck Arbeit verrichtet werden kann. Zudem erteilt sie Auskunft darüber, ob ein entsprechender Prozess freiwillig abläuft und besagt über eine ablaufende Reaktion folgendes:
ΔG < 0: Die Reaktion läuft automatisch ab
ΔG = 0: Die Reaktion ist im Gleichgewicht (es erfolgt keine Verrichtung von Arbeit)
ΔG > 0: Die Reaktion ist nur möglich, wenn sie erzwungen wird (durch Zuführung von Arbeit)
Der absolute Wert der freien Enthalpie ist nicht messbar, jedoch ihre Änderung. Diese Änderung der freien Enthalpie während dem Verlauf einer Reaktion wird auch als freie Reaktionsenthalpie bezeichnet. Diese Änderung der freien Enthalpie eines Prozesses (einer Reaktion) beschreibt das Maß, wie weit ein System von seinem Gleichgewichtszustand entfernt ist.
Isochore Zustandsänderung - Abbildung 3
Isochore Zustandsänderung - Abbildung 4
Isochore Zustandsänderung - Abbildung 5
Mit Hilfe dieses Programms lassen sich unter anderem Grafiken für Arbeitsblätter zur nichtkommerziellen Nutzung für Unterrichtszwecke erstellen. Beachten Sie hierbei jedoch, dass jede Art gewerblicher Nutzung dieser Grafiken und Texte untersagt ist und dass Sie zur Verfielfältigung hiermit erstellter Arbeitsblätter und Unterrichtsmaterialien eine schriftliche Genehmigung des Autors (unseres Unternehmens) benötigen.
Diese kann von einem registrierten Kunden, der im Besitz einer gültigen Softwarelizenz für das entsprechende Programm ist, bei Bedarf unter der ausdrücklichen Schilderung des beabsichtigten Verfielfältigungszwecks sowie der Angabe der Anzahl zu verfielfältigender Exemplare für das entsprechende Arbeitsblatt unter der auf der Impressum-Seite dieses Angebots angegebenen Email-Adresse eingeholt werden. Es gelten unsere AGB.
Dieses Programm eignet sich neben seinem Einsatz als Berechnungs- bzw. Animationsprogramm zudem zum Lernen, zur Aneignung entsprechenden Fachwissens, zum Verstehen sowie zum Lösen verschiedener Aufgaben zum behandelten Fachthema. Durch seine einfache interaktive Handhabbarkeit bietet es die auch Möglichkeit der Durchführung unterschiedlicher Untersuchungen hierzu. Des Weiteren eignet es sich beim Üben dazu, um das Erlernte hinsichtlich praktizierter Übungen bzw. bearbeiteter Übungsaufgaben zu überprüfen und hierzu erworbenes Wissen festigen zu können.
Es kann sowohl zur Einführung in das entsprechende Fachthemengebiet, wie auch zur Erweiterung des bereits hierzu erlangten Fachwissens sowie als Unterstützung bei der Bearbeitung von Anwendungsaufgaben genutzt werden. Des Weiteren eignet es sich auch als Begleiter bei der Bearbeitung von Abituraufgaben sowie zur Vorbereitung auf Klassenarbeiten, zur Unterstützung bei der Abiturvorbereitung und zur Intensivierung des erforderlichen Wissens beim Abitur (Abi) im entsprechenden Leistungskurs (LK).
Mittels der anschaulichen Gestaltung und einfachen Bedienbarbarkeit einzelner Module dieser Software können Fragen zum entsprechenden Themengebiet, die mit den Worten Was ist?, Was sind?, Wie?, Wieviel?, Was bedeutet?, Weshalb?, Warum? beginnen beantwortet werden.
Eine Herleitung dient dazu, zu erklären, weshalb es zu einer Aussage kommt. Derartige Folgerungen sind unter anderem dazu nützlich, um zu verstehen, weshalb eine Formel bzw. Funktion Verwendung finden kann. Dieses Modul kann auch in diesem Fall hilfreich sein und ermöglicht es durch dessen Nutzung oftmals, einer entsprechenden Herleitung bzw. einem Beweis zu folgen, oder einen Begriff zum entsprechenden Fachthema zu erklären.
Bei Fragen deren Wörter Welche?, Welcher?, Welches?, Wodurch? bzw. Wie rechnet man? oder Wie berechnet man? sind, können zugrunde liegende Sachverhalte oftmals einfach erklärt und nachvollzogen werden. Auch liefert diese Applikation zu vielen fachthemenbezogenen Problemen eine Antwort und stellt eine diesbezüglich verständliche Beschreibung bzw. Erklärung bereit.
Eine kleine Übersicht in Form von Bildern und kurzen Beschreibungen über einige zu den einzelnen Fachthemengebieten dieses Programms implementierte Unterprogramme finden Sie unter Kurzbeschreibungen von Modulen zum Themengebiet Mechanik - Kurzbeschreibungen von Modulen zum Themengebiet Elektrotechnik - Kurzbeschreibungen von Modulen zum Themengebiet Optik - Kurzinfos zum Themengebiet Thermodynamik sowie unter Kurzbeschreibungen von Modulen zu sonstigen Themengebieten.
Hilfreiche Informationen zu diesem Fachthema sind unter Wikipedia - Isochore Zustandsänderung zu finden.
Nachfolgend finden Sie ein Video zu diesem Fachthema, welches Sie durch die Ausführung eines Klicks
auf die nachfolgend gezeigte Grafik abspielen lassen können.
Schräger Wurf - Schiefer Wurf, Waagerechter Wurf - Horizontaler Wurf, Hookesches Gesetz, Mechanische Arbeit, Zweites Newtonsches Gesetz, Drittes Newtonsches Gesetz, Gedämpfte mechanische Schwingung, Bewegungen auf einer Kreisbahn, Hebelgesetz, Chaotisches Doppelpendel, Mathematisches Pendel, Freier Fall und Luftwiderstand, Harmonische Schwingungen, Molekularbewegungen, Brownsche Bewegungen, Potentielle und kinetische Energie, Ideale Strömung - Volumenstrom, Druck in Flüssigkeiten, Wellen - Simulationen, Zusammengesetzte Bewegung, Bewegungen in der Ebene, Carnotscher Kreisprozess, Adiabatische Zustandsänderung, Isotherme Zustandsänderung, Isobare Zustandsänderung, Isochore Zustandsänderung, Beugung am Spalt, Hohlspiegel, Sammellinse, Zerstreuungslinse, Wechselstromkreise, RLC-Kreis - RLC-Schaltung, RL-Kreis - RL-Schaltung, RC-Kreis - RC-Schaltung, Resonanz - Resonanzkurve, Widerstände im Wechselstromkreis, Schwingungen und deren Überlagerung, Plattenkondensator, Ladung und Entladung von Kondensatoren, Reihenschaltung und Parallelschaltung, Lissajou-Figuren, 1. Keplersches Gesetz, 2. Keplersches Gesetz, 3. Keplersches Gesetz
Isobare Zustandsänderung - Isotherme Zustandsänderung - Adiabatische Zustandsänderung - Carnotscher Kreisprozess - Aggregatzustände - Mischungsregel - Reales Gas - Molekülgeschwindigkeit
Unterprogramm Isochore Zustandsänderung
PhysProf 1.1 - Unterprogramm RLC-Kreis
MathProf 5.0 - Unterprogramm Kurven in Parameterform

SimPlot 1.0 - Grafik- und Animationsprogramm für unterschiedlichste Anwendungszwecke
Nachfolgend finden Sie ein Video zu einem in PhysProf 1.1 unter dem Themenbereich Mechanik eingebundenen Unterprogramm,welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einem in PhysProf 1.1 unter dem Themenbereich Elektrotechnik eingebundenen Unterprogramm, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einem in PhysProf 1.1 unter dem Themenbereich Thermodynamik eingebundenen Unterprogramm, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einer mit SimPlot 1.0 erstellten Animationsgrafik, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einer mit SimPlot 1.0 erstellten Animationsgrafik, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einer mit SimPlot 1.0 erstellten Animationsgrafik, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.