PhysProf - Aggregatzustand - Fest - Flüssig - Gasförmig - Luftfeuchte

Fachthemen: Aggregatzustände - Wärme - Luftfeuchtigkeit
PhysProf - Wärmelehre - Ein Programm zur Visualisierung physikalischer Sachverhalte mittels Simulationen und 2D-Animationen für das Berufskolleg, für die Oberstufe, für Abiturienten, für Studenten sowie für Lehrer, Ingenieure und alle die sich für Physik interessieren.
Online-Hilfe für das Modul
zur Darstellung und Auswertung von Wärmemengen-Temperatur-Diagrammen für verschiedene flüssige, gasförmige und feste Stoffe hinsichtlich derer Schmelzwärme, Siedewärme und Wärmekapazität.
Dieses Teilprogramm ermöglicht die Durchführung interaktiver Analysen zu diesem Fachthema sowie eine Untersuchung der entsprechenden physikalischen Sachverhalte.
Es unterstützt dabei ein tiefergehendes Verständnis zu diesem Themengebiet zu erlangen und kann zum Lösen vieler diesbezüglich relevanter Aufgaben eingesetzt werden.

Weitere relevante Seiten zu diesem Programm
Themen und Stichworte zu diesem Modul:Aggregatzustand - Aggregatzustände - Aggregatzustandsänderung - Aggregatzustandsänderungen - Übergänge - Phasenübergänge - Phasenübergang - Grundlagen der Thermodynamik - Wärmemenge - Zustände - Fest - Flüssig - Gasförmig - Sieden - Erhitzen - Temperatur - Verdampfen - Kondensieren - Kondensation - Erstarrungswärme - Spezifische Schmelzwärme - Verflüssigen - Lösungswärme - Teilchenmodell - Abkürzungen - Kürzel - Zeichen - Beispiele - Chemie - 20 Grad - Raumtemperatur - Stoff - Stoffe - Definition - Rechner - Herleitung - Beweis - Metalle - Nichtmetalle - Darstellung - Teilchen - Eigenschaften - Fester Zustand - Zustand - Schmelzen - Erstarren - Sublimieren - Resublimieren - Abkühlung - Erwärmung - Abkühlen - Erwärmen - Verdunsten - Verdunstung - Erstarrung - Verdampfung - Verflüssigung - Gefrieren - Verbrennen - Verbrennung - Gefroren - Erstarrt - Erstarrungstemperatur - Phase - Spezifischer Heizwert - Energiezufuhr - Energieabgabe - Erstarrungspunkt - Gefrierpunkt - Phasenumwandlung - Dampf - Verdampfungswärme - Spezifische Verdampfungswärme - Kondensationswärme - Umwandlungswärme - Latente Wärme - Verdampfungsdruck - Sättigungsdampfdruck - Sättigungsdruck - Dampfdruck - Sättigungsmenge - Grundlagen - Dampf - Dampfmenge - Wasserdampf - Gesättigter Dampf - Ungesättigter Dampf - Überhitzter Dampf - Begriff - Begriffe - Einführung - Was - Wie - Weshalb - Was ist - Warum - Bedeutung - Was bedeutet - Erklärung - Einfach erklärt - Beschreibung - Arbeitsblatt - Arbeitsblätter - Unterrichtsmaterial - Unterrichtsmaterialien - Lernen - Erlernen - Aufgaben - Lösungen - Abituraufgaben - Abiturvorbereitung - Abitur - Abi - Leistungskurs - LK - Klassenarbeit - Klassenarbeiten - Anwendungsaufgaben - Schmelzenergie - Verdampfungsenergie - Spezifische Wärmekapazität - Siedetemperatur - Schmelztemperatur - Schmelzwärme - Diagramm - Siedewärme - Abwärme - Phasen - Stoffe - Feste Stoffe - Flüssige Stoffe - Gasförmige Stoffe - Kristallisationswärme - Festkörper - Flüssigkeiten - Flüssigkeit - Gase - Wasser - Gas - Chlor - Schwefel - Brom - Sauerstoff - Methan - Wasserstoff - Eisen - Thermisches Verhalten - Tabelle - Wärmekapazität - Verbrennungswärme - Zustandsgröße - Zustandsgrößen - Intensive Zustandsgröße - Extensive Zustandsgröße - Gesetzmäßigkeiten - Physik - Physikalisch - Formel - Heizwert - Masse - Volumen - Verbrennungsenergie - Feuchte - Feuchtigkeit - Luftfeuchte - Luftfeuchtigkeit - Maximale Feuchte - Maximale Luftfeuchtigkeit - Relative Feuchte - Relative Luftfeuchtigkeit - Absolute Feuchte - Absolute Luftfeuchtigkeit - Wasserdampf - Luft - Volumen - Raum - Wasserdampfgehalt - Wasserdampfpartialdruck - Prozent - 10 - 20 - 30 - 40 - 50 - 60 - 70 - 80 - 90 - 100 - Berechnen - Einheit - Physikalische Einheit - Bild - Grafik - Berechnung - Darstellen - Grafische Darstellung |
 |  |
Aggregatzustände - Luftfeuchtigkeit
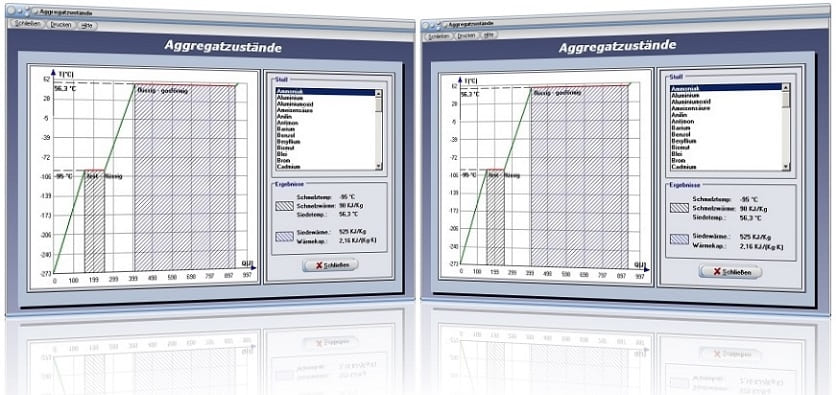
Modul Aggregatzustände
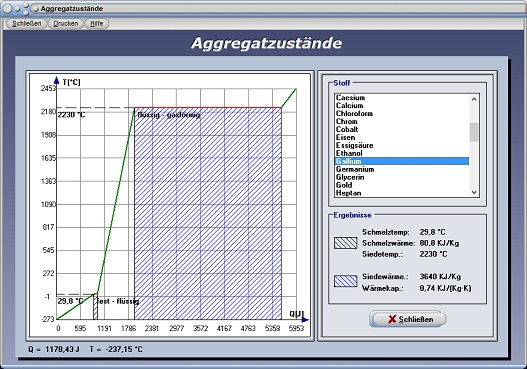
Das Modul [Thermodynamik] - [Aggregatzustände] ermöglicht die Darstellung von Wärmemengen-Temperatur-Diagrammen für verschiedene Stoffe.

Aggregatzustände - Abbildung 1

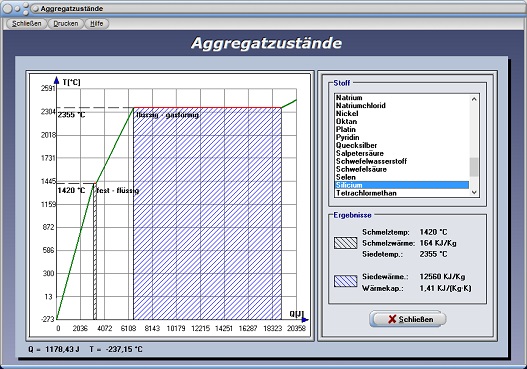
Aggregatzustände - Abbildung 2
Als Aggregatzustände bezeichnet man qualitativ verschiedene temperatur- und druckabhängige physikalische Zustände von Stoffen. Es bestehen drei wichtige Aggregatzustände. Diese sind:
Fest: Der Stoff behält im Allgemeinen sowohl Form als auch Volumen bei.
Flüssig: Der Stoff behält sein Volumen bei, seine Form jedoch ist unbeständig und passt sich dem gegebenen Raum an, in welchem er sich befindet.
Gasförmig: Der Stoff verliert seine Volumenbeständigkeit; ein Gas füllt den zur Verfügung stehenden Raum aus.
Es werden folgende Aggregatzustandsänderungen (Phasenumwandlungen) unterschieden:
Fest-flüssig: Schmelzen
Fest-gasförmig: Sublimieren
Flüssig-fest: Erstarren (Gefrieren)
Flüssig-gasförmig: Verdampfen
Gasförmig-fest: Resublimieren
Gasförmig-flüssig: Kondensieren
Ein Aggregatzuständ wird mit den Kürzeln (Abkürzungen) der englischen Worte s = solid (fest), l = liquid (flüssig) und g = gas (gasförmig) gekennzeichnet. Sie hängen unter anderem von der chemischen Zusammensetzung der entsprechenden Stoffe ab und lassen sich mit Hilfe des Teilchenmodells veranschaulichen. Hierbei werden die kleinsten Teilchen dieses Stoffes in Form von Kugeln dargestellt. Diese Aggregatzustände sind mittels dem Teilchenmodell in der nachfolgend dargestellten Abbildung dargestellt.
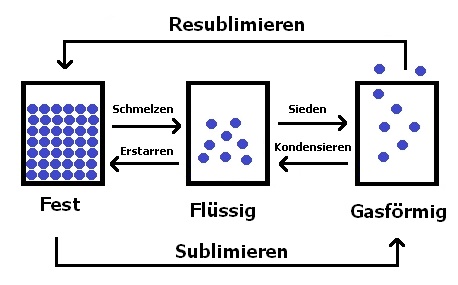
Bei der Aggregatzustandsänderung fest → flüssig entspricht der Schmelzpunkt dem Erstarrungspunkt (Gefrierpunkt). Als Phasenumwandlung wird der Übergang eines Stoffes von einem Zustand in einen anderen bezeichnet.
Unter Schmelzen wird der Phasenübergang eines festen Stoffes oder festen Stoffgemisches in den flüssigen Aggregatzustand verstanden. Der Übergang zu einem höheren Aggregatzustand ist stets mit Energiezufuhr verbunden, beim Übergang zu einem niedrigeren Energiezustand wird Energie abgegeben (Energieabgabe).
Als Phasenübergang wird in diesem Zusammenhang die Umwandlung einer oder mehrerer Phasen eines Stoffes in andere Phasen bezeichnet. Phasenübergänge können zwischen allen Aggregatzuständen eines Stoffes auftreten. Bei allen Phasenübergängen findet eine Änderung der Kristallstruktur der Teilchen des entsprechenden Stoffes statt und es muss entweder Energie zugeführt werden oder es wird Energie frei.
Unter Sublimieren wird der direkte Übergang eines Stoffes vom festen in den gasförmigen Zustand verstanden. Das Resublimieren bezeichnet den direkten Übergang eines gasförmigen in einen festen Zustand. Der Übergang vom flüssigen in den festen Zustand wird als Erstarren (Gefrieren) bezeichnet. Erstarrungstemperatur und Schmelztemperatur sind gleich groß.
Als Verdampfen (Verdampfung) wird der Phasenübergang einer Flüssigkeit oder eines Flüssigkeitsgemisches in den gasförmigen Aggregatzustand bezeichnet. Der Übergang eines Stoffes vom gasförmigen in den flüssigen Aggregatzustand wird Kondensation (Kondensieren) genannt. Mit dem Begriff Verdunstung (Verdunsten) wird der Übergang vom flüssigen in den gasförmigen Zustand beschrieben. Eine Verdunstung liegt vor, wenn die Gasphase über der Flüssigkeit noch nicht mit Dampf gesättigt ist.
Als Verflüssigen oder Verflüssigung wird das Überführen eines Stoffes in den flüssigen Aggregatzustand bezeichnet.
Als Abkühlen (Abkühlung) wird ein Vorgang bezeichnet, bei dem einem Gegenstand oder einem System Wärme entzogen wird. Als Erwärmen (Erwärmung) wird ein Vorgang bezeichnet, bei dem einem Gegenstand oder einem System Wärme zugeführt wird.
Als Gefrierpunkt (Erstarrungspunkt) wird ein Punkt bezeichnet, der sich in einem Phasendiagramm an der Grenze zwischen den beiden Aggregatzuständen fest und flüssig befindet.
Fester Aggregatzustand (fester Zustand): Ein Stoff im festen Zustand besitzt die Bezeichnung Festkörper.
Thermisches Verhalten: Neben der Längenänderung und der Volumenänderung die durch Temperatureinflüsse hervorgerufen werden, zählen Änderungen die durch Aggregatzuständsänderungen bedingt sind, zum thermischen Verhalten von Stoffen.
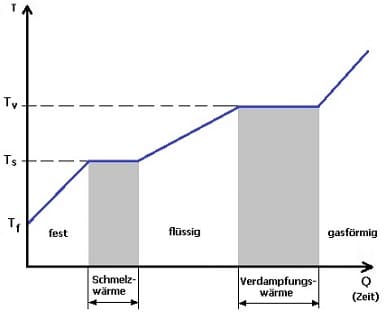
Als Schmelzwärme wird die Energie bezeichnet, welche benötigt wird um eine Stoffprobe von einem festen in einen flüssigen Aggregatzustand zu überführen. Dabei werden Bindungskräfte zwischen Molekülen bzw. Atomen überwunden ohne deren Energie und somit ihre Temperatur zu erhöhen. Als spezifische Schmelzwärme q wird die Wärmemenge bezeichnet, die benötigt wird, um 1 kg eines festen Stoffes ohne Veränderung der Temperatur zu verflüssigen. Die spezifische Schmelzwärme wird auch als Schmelzenergie oder Verdampfungsenergie bezeichnet. Für sie gilt:
q = Qsm/m
q: spezifische Schmelzwärme [J/kg]
Qsm: zum Schmelzen erforderliche Wärmemenge [J]
m: Masse des zu schmelzenden Stoffes [kg]
Zur Umwandlung des Zustands von flüssig zu gasförmig (Verdampfen) ist Umwandlungswärme (Verdampfungswärme) erforderlich. Sie entspricht der Kondensationswärme. Als spezifische Verdampfungswärme r wird die Wärmemenge bezeichnet, die sich auf die Masse der zu verdampfenden Flüssigkeit bezieht. Sie beschreibt die Wärmemenge, die ohne eine Änderung der Temperatur notwendig ist, um 1 kg einer Flüssigkeit zu verdampfen. Es gilt:
r = Qsd/m
r: spezifische Verdampfungswärme [J/kg]
Qsd: zum Verdampfen erforderliche Wärmemenge [J]
m: Masse der zu verdampfenden Flüssigkeit [kg]
Als Lösungswärme wird die Wärmemenge bezeichnet, die zum Lösen eines festen Körpers in einer Flüssigkeit benötigt wird. Die bei der Änderung des Aggregatzustands von flüssig zu fest frei werdende Energie wird Erstarrungswärme oder Kristallisationswärme genannt.
Als latente Wärme wird diejenige Wärmemenge bezeichnet, die bei der Änderung fester, flüssiger oder gasförmiger Aggregatzustände verbraucht wird.
Abwärme ist ein allgemeiner Begriff. Als Abwärme wird die von einem Gerät oder einer Anlage erzeugte Wärme bezeichnet, die (meist) ungenutzt an dessen bzw. deren Umgebung abgegeben wird. Dies ist oftmals erforderlich, um die Überhitzung eines Geräts oder einer Anlage zu verhindern. Zum Einsatz kommen in solchen Fällen beispielsweise Kühler, Kühlgitter und Lüfter.
Die spezifische Wärmekapazität eines Stoffes gibt an, wie viel Wärmeenergie einem Stoff zugeführt werden muss, um seine Temperatur um einen bestimmten Betrag zu erhöhen.
Spezifischer Heizwert - Verbrennungswärme - Verbrennungsenergie
Die bei der Verbrennung frei werdende Energie wird als Verbrennungsenergie (Verbrennungswärme) bezeichnet. Sie gibt an, wie viel Wärme beim Verbrennen eines Stoffes abgegeben wird. Der Heizwert gibt die Menge der Wärmeenergie an, die theoretisch beim Verbrennen eines Stoffes, bezogen auf sein Gewicht bzw. auf sein Volumen, frei wird. Der spezifische Heizwert H stellt das Verhältnis der bei einer Verbrennung frei werdenden Wärmeenergie zur Masse des verbrennenden Stoffes dar. Es gilt:
H = Q/m
H: Spezifischer Heizwert [MJ/kg]
Q: Verbrennungswärme [MJ]
m: Masse [kg]
Die bei einer Verbrennung frei werdende Wärme kann nach folgenden Formeln berechnet werden:
Für gasförmige Stoffe:
Q = H'·VN
Hierbei sind:
Q: Verbrennungswärme [MJ]
H': Heizwert [MJ/l]
VN: Volumen [l]
Für feste und flüssige Stoffe:
Q = H·m
Hierbei sind:
Q: Verbrennungswärme [MJ]
H: Heizwert [MJ/kg]
m: Masse [kg]
Programmbedienung
Mit Hilfe dieses Unterprogramms können Sie sich für viele ausgewählte Stoffe Wärmeenergie-Temperatur-Diagramme veranschaulichen. Wird ein entsprechender Eintrag aus der Listbox gewählt, so stellt das Programm das entsprechende Schaubild dar, welches die Phasenübergänge entsprechend hervorhebt.
Zustandsgrößen
Zustandsgrößen beschreiben unabhängig davon wie sie zustande kamen, die momentane Situation eines (physikalischen) Zustands. Bleiben alle Zustandsgrößen eines Systems unverändert, so befindet sich ein thermodynamisches System im Gleichgewicht.
Intensive Zustandsgrößen eines thermodynamischen Systems sind Druck, chemisches Potential und Temperatur. Erfolgt die Änderung einer intensiven Zustandsgröße, so hat dies stets die Änderung des thermodynamischen Gleichgewichts zur Folge.
Als extensive Zustandsgrößen werden die unter anderem die innere Energie, die freie Energie, die Enthalpie und die Gibbs-Energie bezeichnet. Sie beschreiben das thermodynamische System hinsichtlich ihres Informationsgehalts vollständig.
Extensive Zustandsgrößen sind Zustandsgrößen, deren Dimension mit der Größe des Systems variiert. Intensive Zustandsgrößen sind hingegen Zustandsvariablen, deren Maß nicht von der Größe des Systems abhängig ist. Erfolgt die Teilung eines Systems in zwei gleich große Teile, so halbieren sich alle extensiven Zustandsgrößen. Werden zwei Systeme vereinigt, so verdoppeln sich deren Werte. Bei intensiven Zustandsgrößen erfolgt hingegen keine Veränderung der Werte.
Maximale Luftfeuchtigkeit - Absolute Luftfeuchtigkeit - Relative Luftfeuchtigkeit
Maximale Luftfeuchtigkeit (Sättigungsmenge):
Als maximale Luftfeuchtigkeit oder Sättigungsmenge bzw. Luftfeuchte fmax wird die bei einer bestimmten Temperatur in einem Kubikmeter Luft maximal mögliche Wasserdampfmenge verstanden. Sie wird erreicht, wenn der Wasserdampfpartialdruck in der Luft dem Sättigungsdampfdruck des Wassers bei der entsprechenden Temperatur entspricht. Sie entspricht einer relativen Luftfeuchtigkeit von 100 %.
fmax = maximal mögliche Masse des Wasserdampfs in der Luft / Volumen der Luft
fmax: maximal mögliche Wasserdampfmenge in 1 m³ Luft [g/m³]
Absolute Luftfeuchtigkeit:
Unter der absoluten Luftfeuchtigkeit f wird die in einem Kubikmeter Luft tatsächlich vorhandene Wasserdampfmenge (Wasserdampfgehalt) verstanden.
f = Masse des Wasserdampfs in der Luft / Volumen der Luft
f: Masse der Wasserdampfmenge in 1 m³ Luft [g/m³]
Relative Luftfeuchtigkeit:
Die relative Luftfeuchtigkeit φ ist das Verhältnis der tatsächlich enthaltenen zur maximal möglichen Masse an Wasserdampf in der Luft. Sie bildet das Verhältnis zwischen der absoluten Luftfeuchte und der maximalen Luftfeuchte.
φ = absolute Luftfeuchtigkeit / maximale Luftfeuchtigkeit = f/fmax
Sie wird in den meisten Fällen in Prozent und somit wie folgt angegeben:
φ = f/fmax·100%
Dampf - Sättigungsdampfdruck - Dampfdruck - Gesättigter Dampf - Ungesättigter Dampf - Sättigungsmenge
Grundsätzlich ist zwischen realem Gas, idealem Gas und Dampf zu unterscheiden. Beim idealen Gas vehalten sich Druck p und Volumen V exakt umgekehrt proportional, während dies beim realen Gas nur näherungsweise zutrifft. Bei Dämpfen hingegen ändert sich der Druck bezüglich des Volumens nur in geringem Maße.
Der Dampfdruck (Verdampfungsdruck) ist derjenige temperaturabhängige Druck, der sich einstellt, wenn in einem abgeschlossenen System ein thermodynamisches Gleichgewicht zwischen dem Dampf und der flüssigen Phase herrscht. Der Dampfdruck erhöht sich mit zunehmender Temperatur zu und hängt vom entsprechenden Stoff bzw. Gemisch ab. Beim Wetter ist der Dampfdruck ist ein Maß für den Feuchtigkeitsgehalt der Luft. Er hängt im Wesentlichen von ihrer Temperatur ab.
Als Sättigungsdampfdruck (Sättigungsdruck) wird die Eigenschaft einer Flüssigkeit oder eines Feststoffes bezeichnet, bei dem die gasförmige Phase sich mit dem flüssigen oder festen Aggregatzustand im Gleichgewicht befindet. Hierbei ist der Sättigungsdampfdruck der Druck der gasförmigen Phase. Handelt es sich um einen reinen Stoff, so hängt der Sättigungsdampfdruck exponentiell von der Temperatur des Systems ab. Befinden sich Dampf und Flüssigkeit im thermodynamischen Gleichgewicht, wird von einem Sättigungsdampfdruck gesprochen.
Gesättigter Dampf:
Bei jeder Verdunstung eines Flüssigkeit bildet sich Dampf. Sein Druck wächst bis zum Erreichen eines bestimmten Höchstwerts, dem Sättigungdampfdruck dieser Flüssigkeit. Wenn dieser Druck erreicht wird, dann steht er mit dem Druck in der Flüssigkeit im Gleichgewicht. Dieser Zustand des Dampfs wird als gesättigt bezeichnet. Die in einem Kubikmeter enthaltene Dampfmenge heißt Sättigungsmenge. Ihre Einheit ist [kg/m³].
Ein gesättigter Dampf folgt nicht den Gasgesetzen. Eine Reduzierung des Volumens bewirkt keine Drucksteigerung, sondern führt vielmehr zum Kondensieren des Dampfes und somit zur Bildung von Wasser.
Ungesättigter Dampf:
Steht in einem geschlossenen System nich ausreichend Flüssigkeit zur Verdunstung zur Verfügung, so wird der Sättigungsdampfdruck nie erreicht und es wird von einem ungesättigten Dampf gesprochen. Aus einem gesättigten Dampf entsteht ein ungesättigter Dampf, wenn dessen Volumen vergrößert wird, seine Temperatur erhöht wird oder wenn die restliche im System noch vorhandene Flüssigkeit entzogen wird. Diese Art des Dampfs wird auch als überhitzter Dampf bezeichnet.
Ein ungesättigter Dampf folgt nicht exakt den Gasgesetzen. Mit Hilfe derer können lediglich grobe Näherungen erzielt werden.
In nachfolgend gezeigter Tabelle sind die Werte für den Sättigungsdampfdruck einiger Stoffe bei einer Temperatur von 20° C aufgeführt.
| Sättigungsdampfdruck | |
| Aceton | 24 kPa |
| Ammoniak | 857 MPa |
| Benzol | 10 kPa |
| Butan | 208 MPa |
| Chlorkohlenwasserstoff | 4217 MPa |
| Chloroform | 21,3 KPa |
| Ethanol | 5,87 kPa |
| Methanol | 12,9 kPa |
| Methylchlorid | 489 MPa |
| Methylenchlorid | 46,1 MPa |
| Pentan | 56.5 kPa |
| Propan | 837 MPa |
| Quecksilber | 0,000163 KPa |
| Schwefeldioxid | 330 MPa |
| Schwefelkohlenwasserstoff | 40 kPa |
| Toluol | 2,93 kPa |
| Trichlorethylen | 7,2 kPa |
| Wasser | 2,34 kPa |
In der folgenden Tabelle sind die Werte für den Sättigungsdampfdruck und die Sättigungsmenge für Wasser ausgegeben.
| Temperatur in [°C] | Sättigungsdruck p in [kPa] | Sättigungsmenge fmax in [g/m³] |
| -5 | 0,401 | 3,25 |
| -4 | 0,437 | 3,53 |
| -3 | 0,463 | 3,83 |
| -2 | 0,517 | 4,14 |
| -1 | 0.563 | 4,49 |
| 0 | 0,611 | 4,85 |
| 1 | 0,656 | 5,2 |
| 2 | 0,705 | 5,57 |
| 3 | 0.757 | 5,95 |
| 4 | 0,813 | 6,37 |
| 5 | 0,872 | 6,8 |
| 6 | 0,935 | 7,27 |
| 7 | 1,005 | 7,79 |
| 8 | 1,072 | 8,28 |
| 9 | 1,148 | 8,83 |
| 10 | 1,227 | 9,41 |
| 11 | 1,312 | 10,02 |
| 12 | 1,401 | 10,67 |
| 13 | 1,497 | 11,36 |
| 14 | 1,597 | 12,08 |
| 15 | 1,704 | 12,84 |
| 16 | 1,817 | 13,65 |
| 17 | 1,937 | 14,5 |
| 18 | 2,062 | 15,39 |
| 19 | 2,196 | 16,32 |
| 20 | 2,337 | 17,32 |
| 21 | 2,486 | 18,35 |
| 22 | 2,642 | 19,44 |
| 23 | 2,809 | 20,6 |
| 24 | 2,984 | 21,81 |
| 25 | 3,168 | 23,07 |
| 26 | 3,361 | 24,4 |
| 27 | 3,565 | 25,79 |
| 28 | 3,78 | 27,26 |
| 29 | 4,005 | 28,79 |
| 30 | 4,242 | 30,39 |
Stoffe - Wärmemengen-Temperatur-Diagramme
In diesem Modul besteht die Möglichkeit, sich Wärmemengen-Temperatur-Diagramme für nachfolgend aufgeführte Stoffe ausgeben zu lassen.
| Stoffe |
| Ammoniak |
| Aluminium |
| Aluminiumoxid |
| Ameisensäure |
| Anilin |
| Antimon |
| Barium |
| Benzol |
| Beryllium |
| Bismut |
| Blei |
| Brom |
| Cadmium |
| Caesium |
| Calcium |
| Chloroform |
| Chrom |
| Cobalt |
| Eisen |
| Essigsäure |
| Ethanol |
| Gallium |
| Germanium |
| Glycerin |
| Gold |
| Heptan |
| Hexan |
| Jod |
| Iridium |
| Kalium |
| Kaliumchlorid |
| Kupfer |
| Lithium |
| Magnesium |
| Mangan |
| Methanol |
| Molybdän |
| Natrium |
| Natriumchlorid |
| Nickel |
| Oktan |
| Platin |
| Pyridin |
| Quecksilber |
| Salpetersäure |
| Schwefelwasserstoff |
| Schwefelsäure |
| Selen |
| Silicium |
| Tetrachlormethan |
| Titan |
| Vanadium |
| Wasser |
| Wasser, schwer |
| Wolfram |
| Zink |
| Zinn |
Anbei finden Sie Tabellen einiger Stoffe, welche Auskunft über deren spezifische Schmelzwärme, Siedewärme, Wärmeleitfähigkeit, Wärmekapazität und Heizwerte geben.
1. Spezifische Schmelzwärme
| Stoff | Spezifische Schmelzwärme in [KJ/Kg] |
| Aceton | 98 |
| Aluminium | 397 |
| Aluminiumoxid | 1108 |
| Ameisensäure | 276 |
| Ammoniak | 339 |
| Anilin | 113 |
| Antimon | 167 |
| Barium | 56 |
| Benzol | 128 |
| Beryllium | 1390 |
| Bismut | 52,2 |
| Blei | 23 |
| Brom | 67,8 |
| Butan | 29,3 |
| Cadmium | 56 |
| Caesium | 16,4 |
| Calcium | 216 |
| Chlor | 90,4 |
| Chlorwasserstoff | 56,1 |
| Chrom | 280 |
| Cobalt | 263 |
| Diamant | 16747,2 |
| Eis (0°C) | 332,85 |
| Eisen | 277 |
| Ethan | 92,9 |
| Fluor | 37,7 |
| Germanium | 410 |
| Glycerin | 201 |
| Gold | 65,7 |
| Iod | 124 |
| Kalium | 59,6 |
| Kohlendioxid | 184 |
| Kohlenmonoxid | 30,1 |
| Krypton | 19,7 |
| Kupfer | 205 |
| Lithium | 603 |
| Magnesium | 368 |
| Mangan | 266 |
| Messing | 167,47 |
| Methan | 58,6 |
| Methanol | 92 |
| Molybdän | 290 |
| Natrium | 113 |
| Natriumchlorid | 500 |
| Neon | 16,7 |
| Nickel | 303 |
| Ozon | 43,8 |
| Phenol | 122 |
| Phosphor,weiß | 21 |
| Platin | 111 |
| Propan | 80 |
| Quecksilber | 11,8 |
| Rubidium | 25,7 |
| Salpetersäure | 166,7 |
| Sauerstoff | 13,8 |
| Schwefeldioxid | 116,8 |
| Schwefelsäure | 109 |
| Selen | 68,6 |
| Silber | 105 |
| Silicium | 164 |
| Stahl | 270 |
| Stickstoff | 25,8 |
| Titan | 324 |
| Vanadium | 344 |
| Wasser | 334 |
| Wasserstoff | 58,6 |
| Zink | 111 |
| Zinn | 59,6 |
2. Spezifische Verdampfungswärme
| Stoff | Spezifische Verdampfungswärme in [KJ/Kg] |
| Aceton | 525 |
| Aluminium | 10900 |
| Aluminiumoxid | 4730 |
| Ameisensäure | 432 |
| Ammoniak | 1370 |
| Anilin | 486 |
| Antimon | 1050 |
| Barium | 1100 |
| Benzol | 394 |
| Beryllium | 32600 |
| Bismut | 725 |
| Blei | 8600 |
| Brom | 183 |
| Butan | 385 |
| Cadmium | 890 |
| Caesium | 496 |
| Calcium | 3750 |
| Chlor | 290 |
| Chlorwasserstoff | 443 |
| Chrom | 6700 |
| Eisen | 6340 |
| Ethan | 489 |
| Fluor | 172 |
| Germanium | 4600 |
| Gold | 1650 |
| Iod | 172 |
| Kalium | 1980 |
| Kohlendioxid | 574 |
| Kohlenmonoxid | 216 |
| Krypton | 108 |
| Kupfer | 4790 |
| Lithium | 20500 |
| Magnesium | 5420 |
| Mangan | 4190 |
| Methan | 510 |
| Methanol | 1100 |
| Molybdän | 5610 |
| Natrium | 390 |
| Natriumchlorid | 2900 |
| Neon | 16,7 |
| Nickel | 6480 |
| Ozon | 316 |
| Phenol | 510 |
| Phosphor | 400 |
| Platin | 2290 |
| Propan | 426 |
| Quecksilber | 285 |
| Rubidium | 880 |
| Sauerstoff | 213 |
| Schwefeldioxid | 390 |
| Selen | 1200 |
| Silber | 2350 |
| Silicium | 14050 |
| Stickstoff | 198 |
| Wasser | 2256 |
| Wasserstoff | 454 |
| Zink | 1755 |
| Zinn | 2450 |
3. Siedewärme
| Stoff | Siedewärme in [KJ/Kg] |
| Aceton | 525 |
| Aluminium | 10900 |
| Aluminiumoxid | 4730 |
| Ameisensäure | 432 |
| Ammoniak | 1370 |
| Anilin | 485 |
| Antimon | 1050 |
| Barium | 1100 |
| Benzol | 394 |
| Beryllium | 32600 |
| Bismut | 725 |
| Blei | 8600 |
| Brom | 183 |
| Butan | 385 |
| Cadmium | 890 |
| Caesium | 496 |
| Calcium | 3750 |
| Chlor | 290 |
| Chlorwasserstoff | 443 |
| Chrom | 6712 |
| Cobalt | 4800 |
| Eisen | 6339 |
| Ethan | 489 |
| Fluor | 172 |
| Germanium | 4600 |
| Glycerin | 825 |
| Gold | 1650 |
| Iod | 172 |
| Kalium | 1980 |
| Kohlendioxid | 574 |
| Kohlenmonoxid | 216 |
| Krypton | 108 |
| Kupfer | 4790 |
| Lithium | 20500 |
| Magnesium | 5420 |
| Mangan | 4190 |
| Methan | 510 |
| Methanol | 1100 |
| Molybdän | 5610 |
| Natrium | 3900 |
| Natriumchlorid | 2900 |
| Neon | 105 |
| Nickel | 6480 |
| Ozon | 316 |
| Phenol | 510 |
| Phosphor,weiß | 1674,72 |
| Platin | 2290 |
| Propan | 426 |
| Quecksilber | 285 |
| Rubidium | 880 |
| Salpetersäure | 622 |
| Sauerstoff | 213 |
| Schwefeldioxid | 389 |
| Schwefelsäure | 512 |
| Selen | 1200 |
| Silber | 2357,17 |
| Silicium | 12560,4 |
| Stickstoff | 201 |
| Titan | 8980 |
| Vanadium | 8990 |
| Wasser | 2257 |
| Wasserstoff | 461 |
| Zink | 1755 |
| Zinn | 2450 |
4. Wärmeleitfähigkeit
| Stoff | Wärmeleitfähigkeit in [W/m·K] |
| Aceton | 0,162 |
| Aluminium | 220 |
| Argon | 0,0173 |
| Benzin | 0,12 |
| Benzol | 0,148 |
| Beton | 1 |
| Blei | 34,8 |
| Bronze | 50 |
| Butan | 0,0155 |
| Cadmium | 93 |
| Chloroform | 0,117 |
| Chrom | 93,7 |
| Diamant | 990-2320 |
| Eis (0°C) | 2,2 |
| Essigsäure | 0,16 |
| Glas | 1 |
| Glycerin | 0,285 |
| Gold | 312 |
| Graphit | 169 |
| Gummi | 0,15 |
| Helium | 0,15 |
| Iridium | 59 |
| Kalium | 102,4 |
| Kohlendioxid | 0,016 |
| Kohlenmonoxid | 0,025 |
| Kupfer | 384 |
| Luft | 0,026 |
| Magnesium | 171 |
| Messing | 111 |
| Methan | 0,033 |
| Molybdän | 132 |
| Natrium | 126 |
| Nickel | 91 |
| Petroleum | 0,127 |
| Platin | 70 |
| Polyamid | 0,26 |
| Polystyrol | 0,15 |
| Porzellan | 1 |
| Propan | 0,017 |
| Quecksilber | 8,2 |
| Sauerstoff | 0,026 |
| Schnee | 0,4 |
| Schwefel | 0,3 |
| Silber | 407 |
| Silicium | 148 |
| Speckstein | 3,3 |
| Stahl | 45 |
| Stahlbeton | 1,5 |
| Steinkohle | 0,25 |
| Stickstoff | 0,026 |
| Styropor | 0,036 |
| Teflon | 0,2 |
| Titan | 22 |
| Toluol | 0,133 |
| Wachs | 0,1 |
| Wasser | 0,598 |
| Wasserstoff | 177 |
| Xylol | 0,134 |
| Ziegelstein | 0,6 |
| Zink | 112 |
| Zinn | 65 |
5. Wärmekapazität
| Stoff | Wärmekapazität in [KJ/(Kg·K)] |
| Aceton | 2,16 |
| Aluminium | 0,896 |
| Aluminiumoxid | 0,764 |
| Ameisensäure | 2,15 |
| Ammoniak | 2,16 |
| Anilin | 2,05 |
| Antimon | 0,208 |
| Anilin | 2,05 |
| Antimon | 0,208 |
| Argon | 0,523 |
| Arsen | 0,335 |
| Barium | 0,192 |
| Benzin | 2,09 |
| Benzol | 1,725 |
| Beryllium | 1,59 |
| Beton,lufttrocken | 0,84 |
| Bienenwachs | 2,5 |
| Bismut | 0,124 |
| Blei | 0,129 |
| Brom | 0,46 |
| Butan | 1,658 |
| Cadmium | 0,231 |
| Caesium | 0,236 |
| Calcium | 0,654 |
| Chlor | 0,745 |
| Chloroform | 0,959 |
| Chlorwasserstoff | 0,803 |
| Chrom | 0,44 |
| Cobalt | 0,422 |
| Diamant | 0,502 |
| Eis (0°C) | 2,09 |
| Eisen | 0,452 |
| Essigsäure | 2,052 |
| Ethan | 1,729 |
| Ethanol | 2,43 |
| Ethen | 1,549 |
| Ethin | 1,683 |
| Fett | 2 |
| Fluor | 0,342 |
| Gallium | 0,372 |
| Germanium | 0,322 |
| Gips,gebrannt | 0,8 |
| Glas | 0,86 |
| Glaswolle | 0,8 |
| Glimmer | 0,88 |
| Glycerin | 2,39 |
| Gold | 0,129 |
| Granit | 0,75 |
| Graphit | 0,71 |
| Hartgummi | 1,5 |
| Helium | 5,23 |
| Holz | 2,5 |
| Holzkohle,fest | 0,8 |
| Iod | 0,214 |
| Kalium | 0,75 |
| Kaliumnitrat | 0,942 |
| Kalkstein | 0,88 |
| Kochsalzlösung | 3,62 |
| Kohlendioxid | 0,837 |
| Kohlenmonoxid | 1,042 |
| Konstantan | 0,41 |
| Kork | 1,9 |
| Kupfer | 0,383 |
| Lithium | 3,42 |
| Luft | 1,005 |
| Magnesium | 1,017 |
| Mangan | 0,476 |
| Marmor | 0,8 |
| Messing | 0,385 |
| Methan | 2,219 |
| Methanol | 2,495 |
| Molybdän | 0,251 |
| Natrium | 1,22 |
| Natriumchlorid | 0,867 |
| Neon | 1,03 |
| Nickel | 0,448 |
| Oktan | 2,186 |
| Olivenöl | 1,97 |
| Ozon | 0,795 |
| Papier | 1,5 |
| Petroleum | 2,14 |
| Phosphor,weiß | 0,75 |
| Platin | 0,133 |
| Plexiglas | 1,7 |
| Polyamid | 1,85 |
| Polyethylen | 2,5 |
| Polystyrol | 1,3 |
| Porzellan | 0,84 |
| Propan | 1,595 |
| Propanol | 2,34 |
| PVC | 1,8 |
| Quarzglas | 0,729 |
| Quecksilber | 0,139 |
| Rhenium | 0,137 |
| Rhodium | 0,248 |
| Salpetersäure | 1,72 |
| Salzsäure, 20% | 3,14 |
| Sand,trocken | 0,84 |
| Sauerstoff | 0,917 |
| Schaumstoff | 1,5 |
| Schiefer | 0,75 |
| Schwefeldioxid | 0,64 |
| Schwefelsäure | 1,38 |
| Selen | 0,32 |
| Silber | 0,234 |
| Silicium | 0,703 |
| Stahl,hochlegiert | 0,48 |
| Steinkohle | 1,15 |
| Stickstoff | 1,038 |
| Teflon | 1 |
| Titan | 0,52 |
| Toluol | 1,687 |
| Ton,(10% feucht) | 0,88 |
| Uran | 0,115 |
| Vanadium | 0,49 |
| Wasser | 4,182 |
| Wasserstoff | 14,32 |
| Wolfram | 0,134 |
| Wolle | 1,5 |
| Xenon | 0,159 |
| Zement | 0,75 |
| Zink | 0,385 |
| Zinn | 0,227 |
6. Heizwert
| Stoff | Heizwert in [MJ/kg] |
| Anthrazit | 31 ... 36 |
| Azetylen | 50 |
| Benzin | 44 ... 53 |
| Benzol | 40.2 ... 42.3 |
| Braunkohle | 8 ... 15 |
| Braunkohlenbriketts | 20 |
| Diesel | 41 ... 44 |
| Erdgas | 42 |
| Frisches Holz | 4,2 ... 8,4 |
| Heizöl | 43 |
| Holzkohle | 33,5 |
| Koks | 28,5 ... 30 |
| Methanol | 20 |
| Petroleum | 15 |
| Propan | 47 |
| Spiritus | 39 |
| Stadtgas | 28 |
| Steinkohle | 27 ... 33 |
| Torf, trocken | 15 |
| Holz, trocken | 8 ... 16 |
| Wasserstoff | 133 |
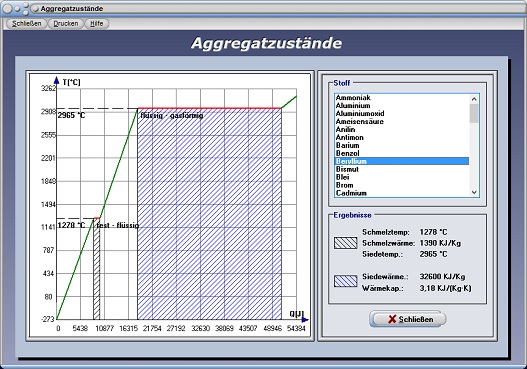
Aggregatzustände - Abbildung 3
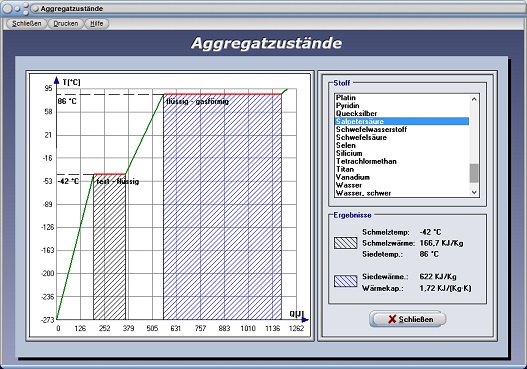
Aggregatzustände - Abbildung 4
Aggregatzustände - Abbildung 5
Aggregatzustände - Abbildung 6
Mit Hilfe dieses Programms lassen sich unter anderem Grafiken für Arbeitsblätter zur nichtkommerziellen Nutzung für Unterrichtszwecke erstellen. Beachten Sie hierbei jedoch, dass jede Art gewerblicher Nutzung dieser Grafiken und Texte untersagt ist und dass Sie zur Verfielfältigung hiermit erstellter Arbeitsblätter und Unterrichtsmaterialien eine schriftliche Genehmigung des Autors (unseres Unternehmens) benötigen.
Diese kann von einem registrierten Kunden, der im Besitz einer gültigen Softwarelizenz für das entsprechende Programm ist, bei Bedarf unter der ausdrücklichen Schilderung des beabsichtigten Verfielfältigungszwecks sowie der Angabe der Anzahl zu verfielfältigender Exemplare für das entsprechende Arbeitsblatt unter der auf der Impressum-Seite dieses Angebots angegebenen Email-Adresse eingeholt werden. Es gelten unsere AGB.
Dieses Programm eignet sich neben seinem Einsatz als Berechnungs- bzw. Animationsprogramm zudem zum Lernen, zur Aneignung entsprechenden Fachwissens, zum Verstehen sowie zum Lösen verschiedener Aufgaben zum behandelten Fachthema. Durch seine einfache interaktive Handhabbarkeit bietet es die auch Möglichkeit der Durchführung unterschiedlicher Untersuchungen hierzu. Des Weiteren eignet es sich beim Üben dazu, um das Erlernte hinsichtlich praktizierter Übungen bzw. bearbeiteter Übungsaufgaben zu überprüfen und hierzu erworbenes Wissen festigen zu können.
Es kann sowohl zur Einführung in das entsprechende Fachthemengebiet, wie auch zur Erweiterung des bereits hierzu erlangten Fachwissens sowie als Unterstützung bei der Bearbeitung von Anwendungsaufgaben genutzt werden. Des Weiteren eignet es sich auch als Begleiter bei der Bearbeitung von Abituraufgaben sowie zur Vorbereitung auf Klassenarbeiten, zur Unterstützung bei der Abiturvorbereitung und zur Intensivierung des erforderlichen Wissens beim Abitur (Abi) im entsprechenden Leistungskurs (LK).
Mittels der anschaulichen Gestaltung und einfachen Bedienbarbarkeit einzelner Module dieser Software können Fragen zum entsprechenden Themengebiet, die mit den Worten Was ist?, Was sind?, Wie?, Wieviel?, Was bedeutet?, Weshalb?, Warum? beginnen beantwortet werden.
Eine Herleitung dient dazu, zu erklären, weshalb es zu einer Aussage kommt. Derartige Folgerungen sind unter anderem dazu nützlich, um zu verstehen, weshalb eine Formel bzw. Funktion Verwendung finden kann. Dieses Modul kann auch in diesem Fall hilfreich sein und ermöglicht es durch dessen Nutzung oftmals, einer entsprechenden Herleitung bzw. einem Beweis zu folgen, oder einen Begriff zum entsprechenden Fachthema zu erklären.
Bei Fragen deren Wörter Welche?, Welcher?, Welches?, Wodurch? bzw. Wie rechnet man? oder Wie berechnet man? sind, können zugrunde liegende Sachverhalte oftmals einfach erklärt und nachvollzogen werden. Auch liefert diese Applikation zu vielen fachthemenbezogenen Problemen eine Antwort und stellt eine diesbezüglich verständliche Beschreibung bzw. Erklärung bereit.
Eine kleine Übersicht in Form von Bildern und kurzen Beschreibungen über einige zu den einzelnen Fachthemengebieten dieses Programms implementierte Unterprogramme finden Sie unter Kurzbeschreibungen von Modulen zum Themengebiet Mechanik - Kurzbeschreibungen von Modulen zum Themengebiet Elektrotechnik - Kurzbeschreibungen von Modulen zum Themengebiet Optik - Kurzinfos zum Themengebiet Thermodynamik sowie unter Kurzbeschreibungen von Modulen zu sonstigen Themengebieten.
Hilfreiche Informationen zu diesem Fachthema sind unter Wikipedia - Aggregatzustand zu finden.
Isochore Zustandsänderung - Isobare Zustandsänderung - Isotherme Zustandsänderung - Adiabatische Zustandsänderung - Carnotscher Kreisprozess - Mischungsregel - Reales Gas - Molekülgeschwindigkeit
Videos zu einigen in PhysProf implementierten Modulen sind auf Youtube unter den folgenden Adressen abrufbar:
Schräger Wurf - Schiefer Wurf, Waagerechter Wurf - Horizontaler Wurf, Hookesches Gesetz, Mechanische Arbeit, Zweites Newtonsches Gesetz, Drittes Newtonsches Gesetz, Gedämpfte mechanische Schwingung, Bewegungen auf einer Kreisbahn, Hebelgesetz, Chaotisches Doppelpendel, Mathematisches Pendel, Freier Fall und Luftwiderstand, Harmonische Schwingungen, Molekularbewegungen, Brownsche Bewegungen, Potentielle und kinetische Energie, Ideale Strömung - Volumenstrom, Druck in Flüssigkeiten, Wellen - Simulationen, Zusammengesetzte Bewegung, Bewegungen in der Ebene, Carnotscher Kreisprozess, Adiabatische Zustandsänderung, Isotherme Zustandsänderung, Isobare Zustandsänderung, Isochore Zustandsänderung, Beugung am Spalt, Hohlspiegel, Sammellinse, Zerstreuungslinse, Wechselstromkreise, RLC-Kreis - RLC-Schaltung, RL-Kreis - RL-Schaltung, RC-Kreis - RC-Schaltung, Resonanz - Resonanzkurve, Widerstände im Wechselstromkreis, Schwingungen und deren Überlagerung, Plattenkondensator, Ladung und Entladung von Kondensatoren, Reihenschaltung und Parallelschaltung, Lissajou-Figuren, 1. Keplersches Gesetz, 2. Keplersches Gesetz, 3. Keplersches Gesetz
Unterprogramm Aggregatzustände
PhysProf 1.1 - Unterprogramm RLC-Kreis
MathProf 5.0 - Unterprogramm Kurven in Parameterform

SimPlot 1.0 - Grafik- und Animationsprogramm für unterschiedlichste Anwendungszwecke
Nachfolgend finden Sie ein Video zu einem in PhysProf 1.1 unter dem Themenbereich Mechanik eingebundenen Unterprogramm,welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einem in PhysProf 1.1 unter dem Themenbereich Elektrotechnik eingebundenen Unterprogramm, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einem in PhysProf 1.1 unter dem Themenbereich Thermodynamik eingebundenen Unterprogramm, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einer mit SimPlot 1.0 erstellten Animationsgrafik, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einer mit SimPlot 1.0 erstellten Animationsgrafik, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.
Nachfolgend finden Sie ein Video zu einer mit SimPlot 1.0 erstellten Animationsgrafik, welches Sie durch die Ausführung eines Klicks auf die nachfolgend gezeigte Grafik abspielen lassen können.